El pH, abreviatura de Potencial Hidrógeno, es
un parámetro muy usado en química para medir el grado de acidez o alcalinidad
de las sustancias. Esto tiene enorme importancia en muchos procesos tanto
químicos como biológicos. Es un factor clave para que muchas reacciones
se hagan o no. Por ejemplo en biología las enzimas responsables de
reacciones bioquímicas tienen una actividad máxima bajo cierto rango de pH.
Fuera de ese rango decae mucho su actividad catalítica. Nuestra sangre tiene un
pH entre 7,35 y 7,45. Apenas fuera de ese rango están comprometidas nuestras
funciones vitales. En los alimentos el pH es un marcador del buen o mal estado
de este. Por lo expuesto el pH tiene enormes aplicaciones.
La escala del pH va desde
0 hasta 14. Los
valores menores que 7 indican el rango de acidez y los mayores que 7 el de
alcalinidad o basicidad. El valor 7 se considera neutro.
Matemáticamente el pH es el logaritmo negativo de la concentración molar de los
iones hidrogeno o protones (H+) o iones
hidronio (H3O).

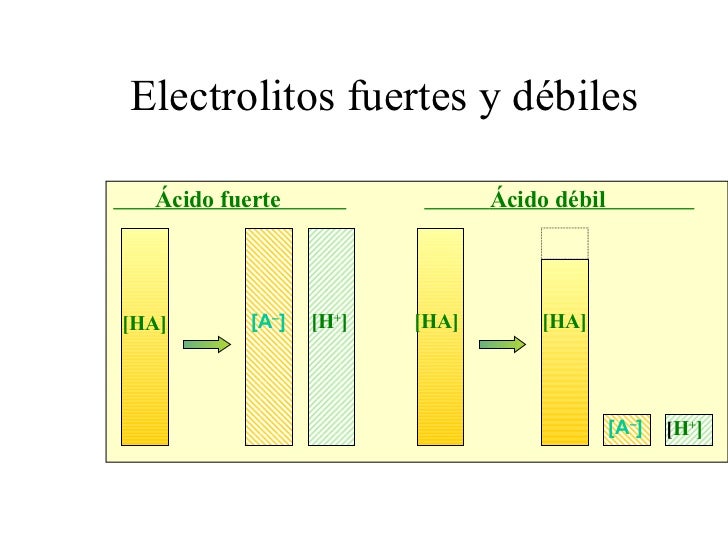
Electrolitos Fuertes y Débiles
Son las sustancias que se
descomponen en iones. Los fuertes se disocian o se separan en un 100% y los
débiles en un muy pequeño porcentaje.
Al separarse en iones muchos de
ellos pueden aportar iones OH– o
iones H+ o H3O+ afectando al pH en cierta medida.
También hay un Potencial oxhidrilo
(pOH) por haber iones OH–.
pOH = -log[OH–]
la suma entre el pOH y el pH nos da
14
pOH + pH = 14
Otra fórmula muy importante que
vincula a los iones H+ y OH– es la
Constante del producto iónico del agua.
Kw = [H+] . [OH–]
Kw = 1.10-14
Nos permite calcular uno de los
iones cuando tenemos el otro ya que su producto siempre da 1.1014 en cualquier situación.
A veces nos piden calcular la
concentración de iones OH– o H+ a partir de los valores de pOH y pH. En estos casos resultan muy
convenientes estas formulas que no son ms que el despeje matemático
de la fórmula de pH.
En el caso de los electrolitos
débiles, es más complicado calcular el pH y debemos recordar el concepto de
equilibrio químico.
El equilibrio químico se aplica a
las reacciones que son reversibles, es decir, que pueden ir en ambas
direcciones. Pero aun así llega un momento en el que la velocidad de reacción
hacia la derecha es igual que hacia la izquierda. En ese punto se establecen
concentraciones de las sustancias que no varían en el tiempo y se puede aplicar
la constante de equilibrio químico.
A + B
<——–> C + D
K = [C] x [D] / [A] x
[B]
Los electrolitos fuertes se
caracterizan por ir en una sola dirección. En los ejemplos vistos anteriormente
las sustancias se descomponen en iones y no hay reversa. En los electrolitos
débiles veremos que la disociación iónica que va hacia la derecha puede tomar
el camino opuesto y generar nuevamente la sustancia no ionizada.
No hay comentarios:
Publicar un comentario